m gram maddenin sıcaklığını \(\Delta t\) kadar yükseltmek için gerekli ısı miktarı :
\(Q = m \cdot c \cdot \Delta T\)
m: Cismin kütlesi (g, kg..)
c: Özgül Isı \((cal/{g^o}C,J/k{g^o}C)\)
Q: Cisme verilen ısı (cal, joule)
Δt: Sıcaklıktaki değişim (°C)
1 cal=4,18 joule
Özgül Isı: Bir maddenin 1g’ının sıcaklığını 1°C değiştirmek için gerekli ısıya denir. “c” ile gösterilir.
Isı Sığası: Bir maddenin özısısı ile kütlesinin çarpımına denir.
\(C = m \cdot c\)
Isı alan maddeler hal değiştirme sıcaklığında değilse sıcaklıkları artar. Sıcaklık artışı alınan ısı ile doğru, maddenin ısı sığası ile ters orantılıdır.
\(\Delta T = \frac{Q}{{mc}}\)
Isı Alış-verişi:
\(\begin{array}{l}{Q_V} = {Q_A}\\{m_1}{c_1}({T_1} – {T_d}) = {m_2}{c_2}({T_d} – {T_2})\\{m_1}{c_1} = {m_2}{c_2} \Rightarrow {T_d} = \frac{{{T_1} + {T_2}}}{2}\\{c_1} = {c_2} \Rightarrow {T_d} = \frac{{{m_1}{T_1} + {m_2}{T_2} + …}}{{{m_1} + {m_2} + …}}\end{array}\)
İki farklı madde farklı sıcaklıkta ise yan yana konur ve ısı alış-verişinde bulunurlar. Sıcaklık alışverişi sıcaklıkları eşit oluncaya kadar sürer.
Bu bölümde örnekleri genellikle sıvılardan seçeriz. Çünkü hem deneyleri daha kolaydır hem de kolayca karışıp ısı alışverişinde bulunurlar. (Sıcaklığı aynı olan iki madde birbirine ısı alışverişinde bulunmaz.)
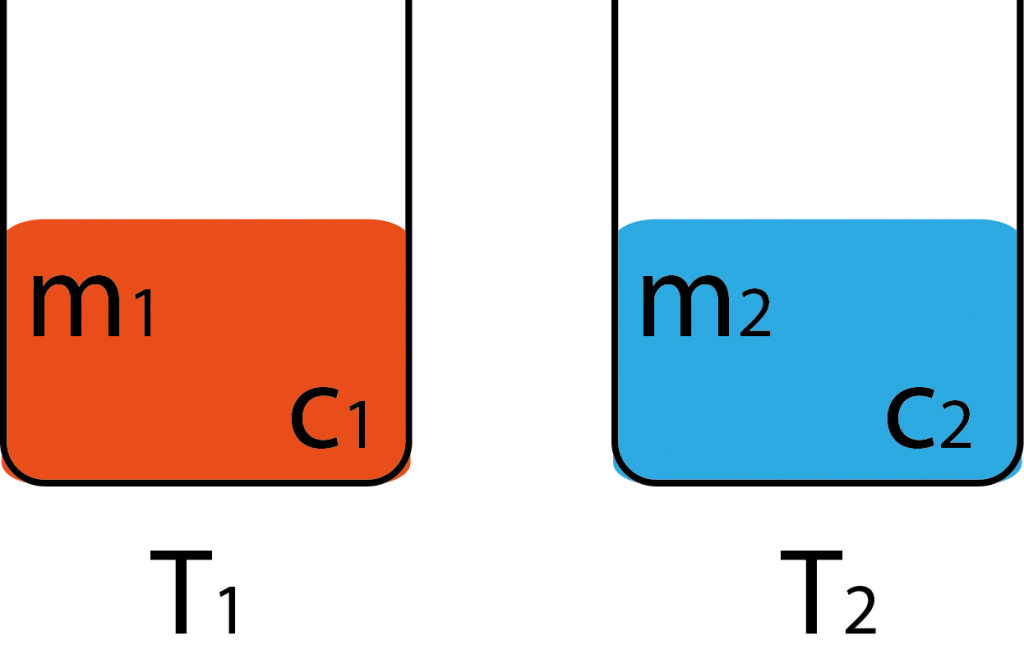
\({T_1} < {T_2}\) olsun. Bu iki sıvı karıştırılırsa \({T_1} < T < {T_2}\) olacak şekilde bir denge sıcaklığına ulaşırlar. (Isı alışverişi sadece sıvılar arasında düşünülmüştür.
Denge sıcaklığı iki sıcaklığın arasında olup ısı sığası çok olanın sıcaklığına daha yakındır.
Sıcaklığı yüksek olan ısı kaybeder, sıcaklığı düşük olan ısı alır. Alınan ısı verilen ısıya eşittir.

